Portal Kudus - Simak soal PTS Kimia kelas 11 semester 2 dan kunci jawaban, contoh soal PTS Kimia kelas 11 semester 2 Kurikulum 2013.
Bagi kalian yang akan hadapi PTS UTS dan mencari soal PTS Kimia kelas 11 SMA SMK MA semester 2 dan kunci jawaban untuk berlatih, simak artikel ini hingga selesai.
Sekalipun sudah ada kunci jawaban semacam ini, tentu akan lebih baik lagi jika para siswa terlebih dahulu mencoba untuk mengerjakannya.
Adanya kunci jawaban ini diharapkan bisa menjadi sebuah referensi atau bahan evaluasi dalam proses belajar mengajar.
Sebagaimana yang dilansir tim PortalKudus dari berbagai sumber berikut ini contoh soal UTS PTS Kimia kelas 11 semester 2 dan kunci jawaban tahun 2023.
Pilihlah salah satu jawaban yang paling tepat pada pilihan A, B, C dan D di bawah ini!
I. Kerjakanlah soal di bawah ini!
1. Suatu system reaksi dalam keadaan setimbang jika .....
A. Reaksinya berlangsung dua arah pada waktu bersamaan
B. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
C. Jumlah mol zat yang ada pada keadaan setimbang selalu sama
D. Masing-masing zat yang bereaksi sudah habis
E. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi
Jawaban: B
2. Kesetimbangan yang terjadi dalam reaksi kimia merupakan kesetimbangan dinamis. Hal ini menunjukkan bahwa .....
A. Laju reaksi pembentukan produk tidak sama dengan laju pembentukan reaktan
B. Secara mikroskopis reaksi berhenti dan konsentrasi zat-zat tetap
C. Selalu ada perubahan menuju produk dan perubahan kembali menjadi reaktan
D. Secara makroskopis reaksi berjalan terus menerus dan konsentrasi tetap
E. Konsentrasi zat-zat pereaksi sama dengan konsentrasi zat hasil reaksi (produk)
Jawaban: E
3. Di antara pernyataan berikut yang bukan merupakan ciri-ciri keadaan setimbang dinamis adalah .....
A. reaksi berlangsung dengan dua arah berlawanan
B. laju reaksi kedua arah sama besar
C. reaksi berlangsung terus-menerus secara mikroskopis
D. setiap komponen pada reaksi tetap ada
E. tidak terjadi perubahan mikroskopis
Jawaban: E
5. Dari percobaan reaksi kesetimbangan :
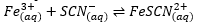
Apabila ke dalam system tersebut ditetesi larutan KSCN yang akan terjadi adalah .....
A. Warna merah larutan menjadi lebih merah
B. Warna merah larutan menjadim lebih muda
C. Larutan KSCN tidak memberikan dampak
D. Ion SCN- akan mengendap sebagai Fe(SCN)3
E. Fe3+ akan mengendap sebagai Fe(OH)3
Jawaban: A
7. Perhatikan beberapa persamaan reaksl berikut:
1). C(s) + H2O(g) ⇆ CO(g) + H2(g)
2). 2SO3(g) ⇆ 2SO2(g) + O2(g)
3). 2NaHCO3(s) ⇆ Na2CO3(s) + H2O(I) + CO2(g)
4). 2HCl(g) + 12O2(g) ⇆ H2O(g) + Cl2(g)
Reaksi heterogen ditunjukkan oleh reaksi nomor .....
A. 1, 2 dan 3 D. 4 saja
B. 1 dan 3 E. semua benar
C. 2 dan 4
Jawaban: B
8. Perhatikan Gambar dibawah ini!
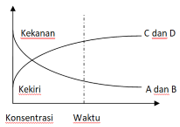
Hasil analisis grafik diatas adalah .....
A. A dan B = C dan D
B. V=[A][B]/[C][D]
C. K=[A][B]/[C][D]
D. C dan D > A dan B
E. C dan D < A dan B
Jawaban: D
9. Di dalam suatu bejana tertutup yang volumenya 2 liter, pada suhu 127℃ terdapat 0,1 mol gas ????????3; 0,2 mol gas ????????2; dan 0,1 mol gas ????2 yang berada dalam reaksi setimbang:
2SO2(g) + O2(g) ⇆ 2SO3(g)
nilai tetapan kesetimbangannya .....
A. 1 D. 4
B. 2 E. 5
C. 3
Jawaban: E
10. Sebanyak 4 mol gas N2O4 dipanaskan dalam suatu ruangan sehingga 50% terdisosiasi membentuk gas NO2 dengan reaksi sebagai berikut:
N2O4 (g) ⇄ 2 NO2 (g)
Jika diketahui tekanan total campuran adalah 5,5 atm maka harga Kp pada suhu itu adalah .....
A. 4 D. 10
B. 6 E. 12
C. 8
Jawaban: C
11. Perhatikan rumus berikut ini!
2H2(g) + O2(g) ⇆ 2H2O(g)
Sebanyak 10 liter gas hydrogen direaksikan dengan 10 liter gas oksigen hingga membentuk reaksi kesetimbangan seperti diatas. Pada saat kesetimbangan, terbentuk 5 liter uap air, diukur pada suhu dan tekanan yang sama. Volume system adalah .....
A. 2,5 liter D. 10 liter
B. 5,0 liter E. 17,5 liter
C. 7,5 liter
Jawaban: B
12. Faktor-faktor yang tidak berpengaruh terhadap kesetimbangan kimia adalah perubahan .....
A. Konsentrasi pereaksi
B. volume ruang
C. konsentrasi katalis
D. tekanan ruang
E. suhu ruang
Jawaban: C
13. Jika ke dalam reaksi kesetimbangan diatas
N2(g) + 3H2(g) ⇆ 2NH3(g)
Ditambahkan 1 mol NH3 maka pergeseran kesetimbangan yang terjadi adalah .....
A. Kesetimbangan akan bergeser ke kiri
B. Kesetimbangan akan bergeser ke kanan
C. Kesetimbangan tidak akan bergeser
D. Tekanan kesetimbangan akan menurun
E. Suhu kesetimbangan akan turun
Jawaban: A
14. Pada reaksi kesetimbangan diatas:
Kesetimbangan system akan bergeser kekiri apabila .....
A. Tekanan di perbesar
B. suhu diturunkan
C. suhu di naikkan
D. volume di perkecil
E. pereaksi di tambah
Jawaban: B
15. Dari reaksi kesetimbangan dibawah ini yang akan bergeser ke kanan jika tekanan di perbesar adalah .....
A. 2Hl(g) ⇆ H2(g) + I2(g)
B. N2O4(g) ⇆ 2NO2(g)
C. CaCO3(s) ⇆ CaO(s) + CO2(g)
D. 2NO(g) + O2(g) ⇆ 2NO2(g)
E. S(s) + O2(g) ⇆ SO2(g)
Jawaban: D
16. Diketahui reaksi kesetimbangan sebagaimana diatas.
2SO3(g) ⇆ 2SO2(g) + O2(g) ∆H = +150 kj/mol
Jika suhu diturunkan, konsentrasi .....
A. SO3 tetap D. SO2 tetap
B. SO3 bertambah E. O2 bertambah
C. SO3 dan O2 tetap
Jawaban: B
17. Asam dan basa merupakan dua senyawa kimia yang sangat penting dalam kehidupan sehari-hari. Sifat asam dan basa dari suatu larutan dapat dijelaskan menggunakan beberapa teori. Menurut Arrhaenius, asam adalah .....
A. Senyawa yang mengandung hydrogen dan larut dalam air
B. Zat yang dalam air akan menjadi donor proton
C. Zat yang larutannya dalam air melepaskan ion H+
D. Senyawa yang bereaksi dengan air menghasilkan ion H3O+
E. Senyawa yang mampu mengikat ion H+ didalam air
Jawaban: C
19. Konsentrasi ion H+ dalam larutan H2SO4 0,05M adalah .....
A. 0,1 D. 0,4
B. 0,2 E. 0,5
C. 0,3
Jawaban: A
20. Nilai pH Larutan basa lemah NH4OH 0,1 M dan Kb = 10-5 adalah .....
A. 9 D. 12
B. 10 E. 13
C. 11
Jawaban: C
21. Larutan asam di bawah ini yang akan memiliki pH paling rendah adalah .....
A. HCN 1 M (Ka = 6 x 10-10)
B. H2S 0,1 M (Ka = 1 x 10-7)
C. Ca(OH)2 0,1 M
D. Ba(OH)2 0,2 M
E. NaOH 0,1 M
Jawaban: A
22. Beberapa larutan diuji dengan kertas lakmus di dapat hasil sebagai berikut:
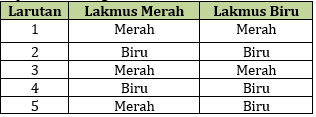
Berdasarkan data diatas, larutan yang bersifat asam adalah .....
A. 1 dan 2 D. 2 dan 4
B. 1 dan 3 E. 4 dan 5
C. 2 dan 3
Jawaban: B
23. Sifat larutan garam yang terhidrolisis dapat dikelompokkan berdasarkan jenis asam dan basa pembentuknya. Jika suatu asam kuat di campur dengan basa lemah, maka akan terbentuk larutan garam yang bersifat .....
A. Asam jika Ka > kb
B. Basa jika Ka < kb
C. netral
D. asam
E. basa
Jawaban: D
24. Berikut adalah beberapa larutan.
(1) NaCl (4) (NH4)2SO4
(2) Na2CO3 (5) Mg2SO4
(3) KCN
Pasangan garam yang pH- nya lebih besar dari 7 ditunjukkan oleh nomor .....
A. 1 dan 2 D. 2 dan 3
B. 1 dan 3 E. 3 dan 5
C. 1 dan 4
Jawaban: A
25. Larutan NaHCO3 dalam air bersifat basA. Reaksi yang menyebabkan terjadinya sifat basa adalah .....
A. Na+ + OH- → NaOH
B. HCO3- + H2O → H2CO3 + OH-
C. Na+ + H2O → NaOH + H+
D. Na+ + HCO3 → NaHCO3
E. HCO3 + H+ → H2CO3
Jawaban: B
26. Jika Ka (CH3COOH) = 1 X 10-5 maka pH larutan CH3COONa 0,1 M adalah .....
A. 3 D. 11
B. 7 E. 13
C. 9
Jawaban: C
28. Pernyataan yang benar tentang larutan penyangga adalah .....
A. mempertahankan pH sistem agar tetap
B. memiliki komponen asam dan basa yang selalu berupa pasangan konjugasi
C. memiliki kapasitas tertentu
D. pengenceran tidak mengubah konsentrasi ion H+ dan OH–
E. mampu mengatasi penambahan asam dan basa dalam jumlah banyak
Jawaban: A
29. Campuran larutan di bawah ini yang dapat membentuk campuran penyangga adalah .....
A. larutan HCl dengan larutan NH4Cl
B. larutan CH3COOH dengan larutan C6H5COOK
C. larutan C2H5OH dengan larutan C2H5ONa
D. larutan Ca(OH)2 dengan larutan CaCl2
E. larutan HCOOH dengan larutan HCOONa
Jawaban: E
30. Campuran berikut ini yang dapat membentuk larutan penyangga adalah .....
A. 100 mL NaOH 0,1 M + 100 mL HCl 0,1 M
B. 100 mL NaOH 0,1 M + 100 mL NaCN 0,1 M
C. 100 mL NaCN 0,1 M + 100 mL HCN 0,1 M
D. 100 mL NH4OH 0,1 M + 50 mL H2SO4 0,1 M
E. 100 mL K2SO4 0,1 M + 50 mL H2SO4 0,1 M
Jawaban: D
32. Dibawah ini yang merupakan pengertian titrasi asam basa adalah .....
A. Titrasi yang didasarkan pada reaksi ionisasi larutan
B. Titrasi yang didasarkan pada volume larutan
C. Titrasi yang didasarkan pada konsentrasi larutan
D. Titrasi yang didasarkan pada reaksi asam basa
E. Titrasi yang didasarkan pada perubahan warna larutan asam
Jawaban: C
33. Seorang siswa sedang melakukan percobaan titrasi larutan CH3COOH dengan larutan NaOH dan menggunakan indikator fenolftalein, titik akhir titrasi dicapai bila .....
A. dalam erlenmeyer terbentuk endapan
B. dalam erlenmeyer terbentuk gas
C. larutan dalam erlenmeyer tidak berwarna
D. warna larutan dalam erlenmeyer menjadi merah tua
E. warna larutan dalam erlenmeyer menjadi merah muda
Jawaban: E
34. Indikator yangs sering digunakan dalam titrasi asam kuat dengan basa kuat, karena lebih tajam warnanya adalah .....
A. Metil Merah D. Lakmus merah
B. Bromtimol biru E. metil jingga
C. fenolftalein
Jawaban: C
35. Dari hasil titrasi larutan KOH 0,1 M dengan HNO3 0,15 M didapat data sebagai berikut.
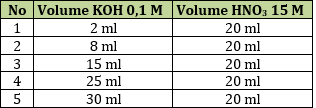
Dari data di atas yang menunjukkan terjadinya titik ekivalen terletak pada percobaan nomor .....
A. 1 D. 4
B. 2 E. 5
C. 3
Jawaban: E
36. Larutan NH4Cl dalam air mempunyai pH < 7. Penjelasan mengenai hal ini adalah .....
A. NH4+ menerima proton dari air
B. Cl- bereaksi dengan air membentuk HCl
C. NH4+ dapat memberi proton kepada air
D. NH4Cl mudah larut dalam air
E. NH3 mempunyai tetapan kesetimbangan yang besar
Jawaban: C
37. Dari garam berikut, yang mengalami hidrolisis total adalah .....
A. NH4Br D. AlCl3
B. K2CO3 E. Al2(CO3)3
C. BaCO3
Jawaban: E
40 SOAL
38. Perhatikan reaksi kesetimbangan larutan penyangga asam di bawah ini.
CH3COOH (aq) ↔ CH3COO-(aq) + H+ (aq)
Kemanakah arah pergeseran kesetimbangan jika ditambahkan H+ dan OH-?
A. Kanan, kanan
B. Kiri, kanan
C. Kanan, kiri
D. Kiri, kiri
E. Tidak mengalami pergeseran kesetimbangan
Jawaban: B
40. Apakah yang dapat diamati jika ke dalam 50 mL larutan penyangga dengan pH = 5 ditambahkan 50 mL aquades?
A. pH akan naik sedikit
B. pH akan turun sedikit
C. pH tidak berubah
D. pH naik drastis
E. pH turun drastis
Jawaban: C
Demikian informasi terkait contoh soal Kimia kelas 11 SMA SMK MA semester 2 dan kunci jawaban 2023.***
*Disclaimer
1. Konten ini dibuat untuk siswa atau orang tua dalam proses evaluasi belajar dalam menemukan soal dan kunci jawaban.
2. Artikel ini tidak mutlak menjamin kebenaran jawaban.
3. Jawaban bersifat terbuka, dimungkinkan bagi guru atau siswa mengeksplorasi jawaban lain yang lebih baik.


![Diketahui A = [[4, 8], [6, 2]] * danI = [[1, 0], [0, 1]] . Jika k Adalah Bilangan Skalar dan (A - kI) Adalah?](https://assets.pikiran-rakyat.com/crop/0x0:0x0/100x100/webp/photo/2024/03/06/3391632659.jpg)


